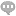蛋白质分离纯化步骤(二) 2.2 蛋白质的抽提 通常选择适当的缓冲液溶剂把蛋白质提取出来。抽提所用缓冲液的pH、离子强度、组成成分等条件的选择应根据欲制备的蛋白质的性质而定。如膜蛋白的抽提,抽提缓冲液中一般要加入表面活性剂(十二烷基磺酸钠、tritonX-100等),使膜结构破坏,利于蛋白质与膜分离。在抽提过程中,应注意温度,避免剧烈搅拌等,以防止蛋白质的变性。 2.3蛋白质粗制品的获得 选用适当的方法将所要的蛋白质与其它杂蛋白分离开来。比较方便的有效方法是根据蛋白质溶解度的差异进行的分离。常用的有下列几种方法: 1. 等电点沉淀法 不同蛋白质的等电点不同,可用等电点沉淀法使它们相互分离。 2. 盐析法 不同蛋白质盐析所需要的盐饱和度不同,所以可通过调节盐浓度将目的蛋白沉淀析出。被盐析沉淀下来的蛋白质仍保持其天然性质,并能再度溶解而不变性,山东化学分析蛋白纯化系统上门维修。 3. 有机溶剂沉淀法 中性有机溶剂如乙醇、**,山东化学分析蛋白纯化系统上门维修,它们的介电常数比水低。能使大多数球状蛋白质在水溶液中的溶解度降低,进而从溶液中沉淀出来,山东化学分析蛋白纯化系统上门维修,因此可用来沉淀蛋白质。此外,有机溶剂会破坏蛋白质表面的水化层,促使蛋白质分子变得不稳定而析出。由于有机溶剂会使蛋白质变性,使用该法时,要注意在低温下操作.山东化学分析蛋白纯化系统上门维修
三、蛋白质分子量的测定 3.2 SDS-聚丙烯酰胺凝胶电泳法测定分子量 蛋白质在普通聚丙烯酰胺凝胶中的电泳速度取决于蛋白质分子大小、所带电荷的量以及分子形状。而SDS-聚丙烯酰胺凝胶电泳与此不同的是在样品及电泳缓冲液中加入了十二烷基***钠(sodium dodecylsulfate,SDS)。SDS是一种阴离子去污剂,可使蛋白质变性并解离成亚基。当蛋白质样品中加入SDS(一般加入量为0.1%)后,SDS与蛋白质分子结合,使蛋白质分子带上大量的负电荷,这些电荷量远远超过蛋白质分子原来所带的电荷量,因而掩盖了不同蛋白质之间的电荷差异。所有结合SDS的蛋白质-SDS复合物的形状近似于长的椭园棒,它们的短轴是恒定的,而长轴与蛋白质分子量的大小成正比。这样,消除了蛋白质之间原有的电荷和形状的差异,电泳的速度只取决于蛋白质分子量的大小。 进行凝胶电泳时,常常用一种染料作前沿物质,蛋白质分子在电泳中的移动距离和前沿物质移动的距离之比值称为相对迁移率,相对迁移率和分子质量的对数成直线关系。以标准蛋白质分子质量的对数和其相对迁移率作图,得到标准曲线。将未知蛋白质在同样条件下电泳,根据测得的样品相对迁移率,从标准曲线上便可查出其分子量。江苏化学分析蛋白纯化系统***的选择
蛋白质分离纯化步骤(二) 2.4.2 纤维素柱层析法 该法是利用蛋白质的酸碱性质作为分离的基础。离子交换纤维素(cellulose ion-exchanger)是人工合成的纤维素衍生物,它具有松散的亲水性网状结构,有较大的表面积,使蛋白质大分子可以自由通过。因此常用于蛋白质的分离。 (1)羧甲基纤维素(CM-纤维素) 在纤维素颗粒上带有羧甲基基团。在中性pH条件下,羧甲基上的质子可解离下来(图2-27a),而溶液中带正电荷的蛋白质分子可与纤维素颗粒上的羧甲基负电荷结合。可交换的基团带正电,因此是一种阳离子交换剂。蛋白质与离子交换纤维素之间结合能力的大小取决于彼此间相反电荷基团之间静电吸引。 (2)二乙氨基乙基纤维素(DEAE-纤维素) 在中性pH条件下,它含有带正电荷的基团,可与溶液中的带负电荷的蛋白质结合,可交换的基团带负电荷,因此是一种阴离子交换剂。当某一蛋白质混合溶液通过装有DEAE-纤维素的层析柱时,带正电荷的蛋白质不能结合而随着洗脱液的流动先被洗脱下来。带负电荷的蛋白质将被结合到柱上。结合力取决于彼此相反电荷基团间的静电吸引。然后选用一定pH和离子强度的缓冲液进行洗脱,改变蛋白质分子所带的静电荷,依次从层析柱流出达到相互分离的目的。
实验室及中试放大规模蛋白纯化系统 Unique Autopure系列蛋白纯化系统 主要应用领域 : – 蛋白纯化系统主要应用于单抗、重组蛋白、疫苗、生化 药、、天然产物和多糖等生物制药领域。用于生物制品的下游工艺的分离纯化。 Unique AutoPure 系列蛋白纯化系统 : 产品特点及优势: – 模块化设计,提供多个配置,满足特殊工艺流程需求 - 低脉动高精度双柱塞输液泵 ,保证优异的分离重现性 ; – 全系统与液体接触的地方均由生物兼容性材料组成、符合FDA、USP VI等相关法规要求 ; – DAD全谱直读检测器,避免了传统的机械切换式检测器所带来的不稳定性及高故障率 ; – 固定波长检测器灯为长寿命LED灯,寿命大于8000小时,降低维护成本 ; – **技术紫外检测器流通池,低死体积、低峰拓展,提高了色谱分离度 ; – 高灵敏度在线pH、电导率、紫外检测器,低死体积、低峰拓展,提高了色谱分离度 ; – 集中了buffer选择阀,自动进样阀、柱位阀等自动化组件,提高了纯化的自动化程度 ; – 具有柱前、柱后、压差报警,气泡传感器检测等功能,极大的保护了系统及层析柱的安全性 ; – 层析工作站软件是一款功能强大、性能先进、高稳定性的色谱数据管理系
三、蛋白质分子量的测定 蛋白质分子量测定的方法很多,目前常用的方法有以下几种。 3.1 凝胶过滤法 凝胶过滤法测定蛋白质分子量的原理如“分离纯化方法”中所 述。一定型号的凝胶颗粒上具有一定大小的孔隙,只允许较小的分子进入胶粒,而大于孔隙的分子则不能进入胶粒而被排阻在胶粒外面。用洗脱液洗脱时,被排阻的分子量大的蛋白质先被洗脱下来,随后能够进入颗粒的蛋白质也按分子量大小而先后被洗脱下来,分子量越小的越后被洗脱下来。由于不同排阻范围的葡聚糖凝胶有一特定的蛋白质分子量范围,在此范围内,分子量的对数和洗脱体积之间成线性关系。因此,用几种已知分子量的蛋白质为标准进行层析分析,以每种蛋白质的洗脱体积对它们的分子量的对数作图,绘制出标准洗脱曲线。未知蛋白质在同样的条件下进行层析分析,根据其所用的洗脱体积,从标准洗脱曲线上可求出此未知蛋白质对应的分子量来。江苏化学分析蛋白纯化系统***的选择
山东化学分析蛋白纯化系统上门维修
蛋白质分离纯化步骤(二) 分离纯化蛋白质的一般程序 2.1 材料的预处理及细胞破碎 分离提纯某一种蛋白质时,首先要把蛋白质从组织或细胞中释放出来并保持原来的天然状态,不丧失活性。所以要采用适当的方法将组织和细胞破碎。常用的破碎组织细胞的方法有: 1. 机械破碎法 这种方法是利用机械力的剪切作用,使细胞破碎。常用设备有,高速组织捣碎机、匀浆器、研钵等。 2. 渗透破碎法 这种方法是在低渗条件使细胞溶胀而破碎。 3. 反复冻融法 生物组织经冻结后,细胞内液结冰膨胀而使细胞胀破。这种方法简单方便,但要注意那些对温度变化敏感的蛋白质不宜采用此法。 4. 超声波法 使用超声波震荡器使细胞膜上所受张力不均而使细胞破碎。 5. 酶法 如用溶菌酶破坏微生物细胞等。山东化学分析蛋白纯化系统上门维修
苏州英赛斯智能科技有限公司位于江苏省苏州市,注册资本200-300万元,旗下拥有11~50人***专业的员工。Inscinstech是苏州英赛斯智能科技有限公司的主营品牌,是专业的机器人与自动化设备、机械电子设备的研发、生产、销售及技术咨询;光学检测设备、光电产品研发、制造、销售;实验室设备、仪器仪表的研发、制造、销售及提供相关的技术咨询和售后服务;自营和代理各类商品及技术的进出口业务(限定企业经营或禁止进出口的商品和技术除外)。(依法需经批准的项目,经相关部门批准后方可开展经营活动)公司,拥有自己**的技术体系。公司以用心服务为**价值,希望通过我们的专业水平和不懈努力,将机器人与自动化设备、机械电子设备的研发、生产、销售及技术咨询;光学检测设备、光电产品研发、制造、销售;实验室设备、仪器仪表的研发、制造、销售及提供相关的技术咨询和售后服务;自营和代理各类商品及技术的进出口业务(限定企业经营或禁止进出口的商品和技术除外)。(依法需经批准的项目,经相关部门批准后方可开展经营活动)等业务进行到底。自公司成立以来,一直秉承“以质量求生存,以信誉求发展”的经营理念,始终坚持以客户的需求和满意为**,为客户提供质量的[ "蛋白纯化色谱系统", "凝胶净化色谱系统", "制备液相色谱", "柱塞泵" ],从而使公司不断发展壮大。
文章来源地址: http://yiqiyibiao.chanpin818.com/swyqxm/qtswyq/deta_4760959.html
免责声明: 本页面所展现的信息及其他相关推荐信息,均来源于其对应的用户,本网对此不承担任何保证责任。如涉及作品内容、 版权和其他问题,请及时与本网联系,我们将核实后进行删除,本网站对此声明具有最终解释权。




 [VIP第1年] 指数:3
[VIP第1年] 指数:3